Note: Descriptions are shown in the official language in which they were submitted.
MÉTHODE ET RÉACTEUR POUR LA PRODUCTION DE GAZ DE SYNTHESE
A PARTIR D'UNE SOURCE DE CARBONE ET D'HYDROGENE EN
PRÉSENCE D'UNE OXY-FLAMME
DEMANDE PRIORITAIRE
La présente demande revendique la priorité de la demande canadienne
CA 3.081.971, déposée le 4 juin 2020.
DOMAINE TECHNIQUE
La présente demande se rapporte à une méthode et un réacteur pour produire un
gaz de synthèse à partir d'une source de carbone et d'hydrogène (H2). Plus
particulièrement, la méthode de production du gaz de synthèse est réalisée en
présence directe d'une Oxy-flamme pour transformer un flux comprenant une
source de carbone et de l'hydrogène en gaz de synthèse.
ÉTAT DE LA TECHNIQUE
La lutte contre les changements climatiques va devoir impliquer, entre autres,
une
diminution substantielle des émissions de Gaz à Effet de Serre (GES),
notamment
celles de CO2 et méthane. Pour ce faire, au-delà de toute mesure liée à des
améliorations incrémentales, des moyens drastiques seront nécessaires pour
pouvoir atteindre les objectifs visés en matière de diminution des émissions
de
GES. A l'heure actuelle, des efforts considérables sont réalisés pour
minimiser la
consommation de ressources fossiles en tant que source d'énergie et aussi en
tant
qu'ingrédient de base pour plusieurs synthèses chimiques. Pour la fabrication
de
produits contenant du carbone dans leur composition atomique, l'utilisation du
CO2
comme réactif de base pour fournir la source de carbone est une solution
prometteuse. Le CO2 se retrouve dans l'air ambiant, mais aussi dans les rejets
atmosphériques issus de procédés industriels émetteurs de CO2 (ex: cimenterie,
aluminerie, aciérie, etc.). Le procédé de capture de CO2 de l'air ambiant ou
rejeté
par des procédés industriels pour le recycler pour une utilisation ultérieure
est
aussi connu sous le nom Carbone Capture Utilization (CCU). Le CO2 ainsi
1
Date Reçue/Date Received 2023-05-25
WO 2021/243462
PCT/CA2021/050761
capté peut être utilisé en tant que source de carbone pour la production d'un
large
spectre de produits que l'on peut considérer comme étant carboneutres, i.e.,
dont
le cycle de production et d'utilisation n'implique pratiquement pas d'émission
nette
de GES. Il est ainsi possible de produire des carburants synthétiques
carboneutres
qui peuvent être utilisés dans les infrastructures existantes.
Il y a plusieurs moyens d'utiliser du CO2 en tant que réactif de base pour
fournir du
carbone. Le moyen le plus pratique consiste à transformer le CO2 en monoxyde
de
carbone (CO) selon la réaction (A) appelée Reverse VVater Gas Shift ou
RVVGS.
CO2 + H2 CO + H20 (vapeur) (A)
En faisant réagir du CO2 avec un excès d'hydrogène (H2), on peut produire des
mélanges à base d'hydrogène et de CO. De tels mélanges sont appelés gaz de
synthèse ou syngas en anglais. Ces gaz de synthèse peuvent également
contenir un peu de CO2 résiduel.
Les gaz de synthèse peuvent être utilisés pour produire un spectre de produits
chimiques de base. Parmi ces produits, on retrouve notamment le méthanol et
les
hydrocarbures tels que ceux qu'on retrouve dans l'essence à moteur, le diesel,
le
kérosène.
Le méthanol est une molécule plate-forme pouvant servir de matière première
pour
un grand nombre d'autres produits de base tels que le form aldéhyde. Le
méthanol
est aussi connu pour son utilisation dans le liquide lave-glace et en tant que
solvant
industriel. Il peut aussi être utilisé comme combustible. Le méthanol peut
même
être transformé en hydrocarbures synthétiques. Enfin, le méthanol peut être
transformé en diméthyléther (DME), lui-même un intermédiaire chimique. Le DME
est utilisé entre autres comme agent de propulsion pour les aérosols. Le DME
peut
servir de carburant pour moteur diesel ou de carburant de substitution au
propane.
Une réaction de base connue, pour la production de méthanol à partir de gaz de
synthèse, est la réaction (B) suivante:
CO +2 H2 CH3OH (B)
2
CA 03166916 2022- 8- 3
WO 2021/243462
PCT/CA2021/050761
Des hydrocarbures synthétiques peuvent être produits à partir de gaz de
synthèse,
selon la réaction (C) de Fischer-Tropsch :
n CO + 2n H2 -(CH2)n- n H20 (C)
Dépendamment des produits chimiques à fabriquer, les mélanges à base de
CO/H2 utiles comme gaz de synthèse pour ces produits, doivent être balancés,
i.e., ils doivent contenir les bonnes proportions de H2 et de CO. En
considérant les
réactions (B) et (C), on constate que, en théorie, le gaz de synthèse (syngas)
doit
contenir essentiellement du H2 et du CO selon un rapport molaire H2/C0 proche
de 2. Plus précisément, tenant compte de la présence possible de CO2 résiduel
dans les gaz de synthèse, les proportions molaires des gaz pour pouvoir
réaliser
les réactions (B) ou (C) correspondent généralement aux ratios R1 ou R2 des
équations (D) et (E) suivantes :
(D) R1 = H2/C0 2
(E) R2 = (H2-0O2) / (CO + CO2) > 2
Un très grand nombre de synthèses chimiques et d'hydrocarbures peuvent être
réalisées avec des syngas pouvant respecter les critères de composition
molaire
R1 ou R2. Il est aussi à noter qu'il est possible de produire du méthane, CH4,
à
partir de gaz de synthèse. Une mole de méthane peut être formée à partir de 1
mole de CO et 3 moles de H2.
La réaction du RVVGS (A) est endothermique (enthalpie de réaction de 41
kJ/mole
à la température ambiante). Selon la stoechiométrie de cette réaction, pour
produire 1 kg de CO, il faut 1,57 kg de CO2 et 0,07 kg de H2 et il faut
fournir 1465
kJ ou encore 0.4 kWh d'énergie thermique. Pour réaliser cette réaction, on a
généralement recours à des réacteurs à lits catalytiques. Or, l'usage de
catalyseurs conventionnels pour réaliser la réaction (A) ne permet pas
d'obtenir
des taux de conversion élevés. Cela signifie que la conversion par passe, soit
la
conversion lors du passage de CO2 au travers d'un lit catalytique, s'avère
plutôt
faible. La raison est que, pour des réacteurs à lits catalytiques, la
température de
3
CA 03166916 2022- 8- 3
WO 2021/243462
PCT/CA2021/050761
fonctionnement est plutôt limitée - on parle souvent de températures
inférieures à
600 C. Or, il est connu que, sur le plan thermodynamique, la réaction (A)
devient
plutôt favorable à des niveaux de température plus élevés. Ceci est illustré
par le
Tableau 1 qui présente la valeur de la constante d'équilibre en fonction de la
température (à pression atmosphérique).
Tableau 1 : Variation de la constante d'équilibre de la réaction du RVVGS avec
la
température
T AH K
C kJ/mole
0 41,20 0,0000021
100 40,78 0,0002704
200 40,08 0,0043
300 39,22 0,0248
400 38,25 0,0830
500 37,22 0,1987
600 36,18 0,3822
700 35,14 0,6334
800 34,12 0,9439
900 33,13 1,3017
1000 32,19 1,6935
1100 31,30 2,1071
1200 30,46 2,5319
1300 29,65 2,9595
1400 28,89 3,3831
1500 28,16 3,7980
Une méthode pour la production de gaz de synthèse à partir d'une source de
carbone et d'hydrogène est particulièrement intéressante. Une méthode pour la
production de gaz de synthèse à partir de CO2 par exemple, et d'hydrogène,
sans
avoir recours à l'utilisation de catalyseurs solides conventionnels, est aussi
particulièrement intéressante. Une méthode pour permettre la préparation de
gaz
4
CA 03166916 2022- 8- 3
WO 2021/243462
PCT/CA2021/050761
de synthèse utiles pour la fabrication de produits chimiques variés est
également
attrayante. Une telle méthode va être décrite dans ce qui suit.
SOMMAIRE
Selon un premier aspect, la présente technologie concerne une méthode de
production de gaz de synthèse comprenant du monoxyde de carbone (CO) et de
l'hydrogène (H2), dans laquelle le gaz de synthèse est produit par une
réaction de
réduction d'un premier flux comprenant une source de carbone et un excès
d'hydrogène au contact d'une Oxy-flamme, et dans laquelle :
l'hydrogène provient d'un courant réducteur dont une première partie se
retrouve dans le premier flux et une seconde partie est utilisée pour générer
l'Oxy-
flamme par combustion de l'hydrogène en présence d'un second flux comprenant
de l'oxygène (02), le second flux provenant d'un courant oxydant,
le premier flux et le second flux sont à une distance l'un de l'autre telle
que
l'Oxy-flamme soutient la réaction entre la source de carbone et l'hydrogène.
Selon un mode de réalisation, la méthode est telle que la réaction de
réduction est
réalisée en l'absence de catalyseur solide.
Selon un autre mode de réalisation, la méthode est telle que l'Oxy-flamme
génère
des espèces ioniques et des radicaux libres qui favorisent la conversion de la
source de carbone en CO.
Selon un autre mode de réalisation, la méthode est telle que la source de
carbone
comprend :
- du CO2; ou
- au moins un type de molécules oxygénées de formule CaHpOy où a est
compris entre 1 et 5, 13 est compris entre 2 et 10 et y est compris entre 1 et
4; ou
- un ou des hydrocarbures; ou
- un mélange d'au moins deux de ces sources de carbone.
5
CA 03166916 2022- 8- 3
WO 2021/243462
PCT/CA2021/050761
Selon un autre mode de réalisation, la source de carbone comprend du CO2 et la
réaction de réduction comprend une réaction inverse du gaz à l'eau ou
Reverse
Water Gas Shift ).
Selon un autre mode de réalisation, la méthode est telle que le courant
réducteur
est de l'hydrogène. Selon un autre mode de réalisation, le courant réducteur
comprend de l'hydrogène et la source de carbone Selon un autre mode de
réalisation, le courant réducteur comprend de l'hydrogène et du 002.
Selon un autre mode de réalisation, la méthode est telle que le courant
réducteur
comprend de l'hydrogène, du CO2 et au moins un type de molécules oxygénées
de formule CaHpOy où a est compris entre 1 et 5, f3 est compris entre 2 et 10
et y
est compris entre 1 et 4.
Selon un autre mode de réalisation, la méthode est telle que le courant
oxydant
est de l'oxygène. Selon un autre mode de réalisation, le courant oxydant
comprend
de l'oxygène et du CO2.
Selon un autre mode de réalisation, la méthode est telle que le courant
réducteur
comprend uniquement de l'hydrogène, le courant oxydant comprend uniquement
de l'oxygène et la source de carbone est alimentée par un courant indépendant.
Selon un autre mode de réalisation, le courant indépendant comprend du CO2.
Selon un autre mode de réalisation, le courant indépendant comprend du CO2 et
du méthane.
Selon un autre mode de réalisation, la méthode est telle que l'oxygène
provient
d'une réaction d'électrolyse de l'eau.
Selon un autre mode de réalisation, la méthode est telle que l'hydrogène
provient
d'une réaction d'électrolyse de l'eau.
Selon un autre mode de réalisation, la méthode est telle que la source de
carbone
provient d'un mélange gazeux issu d'un procédé de gazéification ou de pyrolyse
de biomasse.
6
CA 03166916 2022- 8- 3
WO 2021/243462
PCT/CA2021/050761
Selon un autre mode de réalisation, la méthode est telle que la réaction de
réduction est réalisée à une température moyenne d'au moins 600 C. Selon un
autre mode de réalisation, la réaction de réduction est réalisée à une
température
moyenne d'au moins 1200 C. Selon un autre mode de réalisation, la réaction de
réduction est réalisée à une température moyenne d'au plus 2200 C.
Selon un autre mode de réalisation, la méthode est telle que le premier flux
et le
second flux sont à une distance l'un de l'autre comprise entre 0,1 mm et 100
mm.
Selon un autre mode de réalisation, le premier flux et le second flux sont à
une
distance l'un de l'autre comprise entre 0,3 mm et 50 mm. Selon un autre mode
de
réalisation, le premier flux et le second flux sont à une distance l'un de
l'autre
comprise entre 0,6 mm et 30 mm.
Selon un autre mode de réalisation, la méthode est telle que la source de
carbone
comprend du CO2 et la réaction de réduction est réalisée en utilisant un ratio
molaire H2/CO2 compris entre 2 et 7.
Selon un autre mode de réalisation, la méthode est telle que la source de
carbone
comprend du CO2 et la réaction de réduction est réalisée en utilisant un ratio
molaire 02/CO2 compris entre 0,35 et 0,9.
Selon un autre mode de réalisation, la méthode est telle que la réaction de
réduction est réalisée en utilisant un ratio molaire 02/H2 compris entre 0,1
et 0,3.
Selon un autre mode de réalisation, la méthode est telle que le gaz de
synthèse
produit a un rapport molaire H2/C0 d'au moins 1,8. Selon un autre mode de
réalisation, le gaz de synthèse produit a un rapport molaire H2/C0 d'au moins
2.
Selon un autre mode de réalisation, le gaz de synthèse produit a un rapport
molaire
H2/C0 compris entre 1,8 et 5,0.
Selon un autre mode de réalisation, la méthode est telle que le gaz de
synthèse
produit comprend en outre du CO2.
7
CA 03166916 2022- 8- 3
Selon un autre mode de réalisation, la méthode est telle que le gaz de
synthèse
produit a un ratio molaire en H2, CO et CO2 tel que (H2 - CO2) / (CO + CO2) 2.
Selon un autre mode de réalisation, la méthode comprend en outre un
refroidissement du gaz de synthèse pour former un gaz de synthèse refroidi.
Selon un autre mode de réalisation, la méthode comprend en outre une
condensation d'eau contenue dans le gaz de synthèse refroidi et récupération
de
l'eau. Selon un autre mode de réalisation, au moins une partie de l'eau
récupérée
est recyclée à l'étape de refroidissement.
Selon un autre aspect, la présente technologie concerne l'utilisation d'un gaz
de
synthèse produit par la méthode selon la présente technologie, pour la
fabrication
de produits chimiques ou carburants.
Selon un autre aspect, la présente technologie concerne l'utilisation d'un gaz
de
synthèse produit par la méthode selon la présente technologie, pour la
fabrication
de méthanol ou d'hydrocarbures synthétiques.
Selon un autre aspect, la présente technologie concerne un réacteur pour
produire
un gaz de synthèse comprenant du monoxyde de carbone (CO) et de l'hydrogène
(H2), ledit réacteur comprenant :
une chambre de réaction dans laquelle le gaz de synthèse est produit par
une réaction de réduction d'un premier flux comprenant une source de carbone
et
un excès d'hydrogène au contact d'une Oxy-flamme,
au moins un premier moyen pour alimenter la chambre de réaction avec un
courant réducteur comprenant l'hydrogène, une première partie du courant
réducteur se retrouvant dans le premier flux et une seconde partie étant
utilisée
pour générer l'Oxy-flamme dans la chambre de réaction, par combustion de
l'hydrogène en présence d'un second flux comprenant de l'oxygène (02),
au moins un second moyen pour alimenter la chambre de réaction avec un
courant oxydant formant le second flux,
8
Date Reçue/Date Received 2023-05-25
WO 2021/243462
PCT/CA2021/050761
le premier flux et le second flux étant à une distance l'un de l'autre telle
que
l'Oxy-flamme soutient la réaction entre la source de carbone et l'hydrogène.
Selon un mode de réalisation, le réacteur est tel que la réaction de réduction
est
réalisée en l'absence de catalyseur solide.
Selon un autre mode de réalisation, le réacteur est tel que l'Oxy-flamme
génère
des espèces ioniques et des radicaux libres qui favorisent la conversion de la
source de carbone en CO.
Selon un autre mode de réalisation, le réacteur est tel que la source de
carbone
comprend :
du CO2; ou
- au moins un type de molécules oxygénées de formule CaHpOy où a est
compris entre 1 et 5, p est compris entre 2 et 10 et y est compris entre 1 et
4; ou
- un ou des hydrocarbures; ou
- un mélange d'au moins deux de ces sources de carbone.
Selon un autre mode de réalisation, le réacteur est tel que la source de
carbone
comprend du CO2 et la réaction de réduction est la réaction inverse du gaz à
l'eau
ou Reverse Water Gas Shift .
Selon un autre mode de réalisation, le réacteur est tel que le courant
réducteur est
de l'hydrogène. Selon un autre mode de réalisation, le courant réducteur
comprend de l'hydrogène et la source de carbone. Selon un autre mode de
réalisation, le courant réducteur comprend de l'hydrogène et du CO2.
Selon un autre mode de réalisation, le réacteur est tel que le courant
réducteur
comprend de l'hydrogène, du CO2 et au moins un type de molécules oxygénées
de formule CaHpOy où a est compris entre 1 et 5, 13 est compris entre 2 et 10
et y
est compris entre 1 et 4.
9
CA 03166916 2022- 8- 3
WO 2021/243462
PCT/CA2021/050761
Selon un autre mode de réalisation, le réacteur est tel que le courant oxydant
est
de l'oxygène. Selon un autre mode de réalisation, le courant oxydant comprend
de l'oxygène et du CO2.
Selon un autre mode de réalisation, le réacteur est tel que le premier moyen
pour
alimenter le courant réducteur et le second moyen pour alimenter le courant
oxydant sont des tubes.
Selon un autre mode de réalisation, le réacteur comprend une pluralité de
seconds
moyens consistant en une pluralité de tubes permettant l'injection du courant
oxydant dans la chambre de réaction, et une pluralité de premiers moyens
consistant en une pluralité d'ouvertures permettant l'injection du courant
réducteur
dans la chambre de réaction. Selon un autre mode de réalisation, chaque
ouverture est définie par un espace annulaire délimité par le diamètre externe
d'un
tube de la pluralité de tubes et s'étendant perpendiculairement à partir de la
paroi
externe du tube. Selon un autre mode de réalisation, le réacteur comprend en
outre une chambre de distribution du courant réducteur séparée de la chambre
de
réaction par une paroi de séparation, ladite chambre de distribution et ladite
paroi
de séparation étant traversées par la pluralité de tubes, l'espace annulaire
s'étendant perpendiculairement à partir de la paroi externe de chaque tube
traversant également la paroi de séparation.
Selon un autre mode de réalisation, le réacteur est tel que le courant
réducteur est
de l'hydrogène qui est alimenté dans la chambre réaction par le premier moyen
consistant en un premier tube, le courant oxydant est de l'oxygène qui est
alimenté
dans la chambre réaction par le second moyen consistant en un second tube, et
la source de carbone est alimentée par un courant indépendant qui est injecté
dans la chambre de réaction par au moins une ouverture située dans une paroi
de
la chambre de réaction. Selon un autre mode de réalisation, l'ouverture est
formée
par un troisième tube concentrique avec le premier tube et le second tube, le
second tube formant le tube intérieur, le premier tube formant un tube
intermédiaire
et le troisième tube formant un tube extérieur. Selon un autre mode de
réalisation,
CA 03166916 2022- 8- 3
WO 2021/243462
PCT/CA2021/050761
l'ouverture est formée par un espace annulaire délimité par un diamètre
interne du
troisième tube et un diamètre externe du premier tube. Selon un autre mode de
réalisation, le réacteur comprend en outre une chambre de distribution séparée
de
la chambre de réaction par une paroi de séparation, ladite chambre de
distribution
servant pour alimenter le courant indépendant comprenant la source de carbone
et étant traversée par le premier tube et le second tube. Selon un autre mode
de
réalisation, le réacteur est tel que le courant indépendant comprend du CO2.
Selon
un autre mode de réalisation, le réacteur est tel que le courant indépendant
comprend du CO2 et du méthane.
ir)
Selon un autre mode de réalisation, le réacteur est tel que l'oxygène provient
d'une
réaction d'électrolyse de l'eau.
Selon un autre mode de réalisation, le réacteur est tel que l'hydrogène
provient
d'une réaction d'électrolyse de l'eau.
Selon un autre mode de réalisation, le réacteur est tel que la source de
carbone
provient d'un mélange gazeux issu d'un procédé de gazéification ou de pyrolyse
de biomasse.
Selon un autre mode de réalisation, le réacteur est tel que la chambre de
réaction
atteint une température d'au moins 600 C pendant la réaction de réduction.
Selon
un autre mode de réalisation, la chambre de réaction atteint une température
d'au
moins 1200 C pendant la réaction de réduction. Selon un autre mode de
réalisation, la chambre de réaction atteint une température d'au plus 2200 C
pendant la réaction de réduction.
Selon un autre mode de réalisation, le réacteur est tel que le premier flux et
le
second flux sont à une distance l'un de l'autre comprise entre 0,1 mm et 100
mm.
Selon un autre mode de réalisation, le premier flux et le second flux sont à
une
distance l'un de l'autre comprise entre 0,3 mm et 50 mm. Selon un autre mode
de
réalisation, le premier flux et le second flux sont à une distance l'un de
l'autre
comprise entre 0,6 mm et 30 mm.
11
CA 03166916 2022- 8- 3
WO 2021/243462
PCT/CA2021/050761
Selon un autre mode de réalisation, le réacteur est tel que la source de
carbone
comprend du CO2 et la réaction de réduction est réalisée en utilisant un ratio
molaire H2/CO2 compris entre 2 et 7. Selon un autre mode de réalisation, la
source
de carbone comprend du CO2 et la réaction de réduction est réalisée en
utilisant
un ratio molaire 02/002 compris entre 0,35 et 0,9.
Selon un autre mode de réalisation, le réacteur est tel que la réaction de
réduction
est réalisée en utilisant un ratio molaire 02/H2 compris entre 0,1 et 0,3.
Selon un autre mode de réalisation, le réacteur est tel que le gaz de synthèse
produit a un rapport molaire H2/C0 d'au moins 1,8. Selon un autre mode de
réalisation, le gaz de synthèse produit a un rapport molaire H2/C0 d'au moins
2.
Selon un autre mode de réalisation, le gaz de synthèse produit a un rapport
molaire
1-12/C0 compris entre 1,8 et 5,0.
Selon un autre mode de réalisation, le réacteur est tel que le gaz de synthèse
produit comprend en outre du CO2.
Selon un autre mode de réalisation, le réacteur est tel que le gaz de synthèse
produit a un ratio molaire en H2, CO et CO2 tel que (H2 - CO2) /(00 + CO2) 2.
Selon encore un autre aspect, la présente technologie concerne un système
comprenant le réacteur tel que défini selon la présente technologie, couplé à
un
dispositif de refroidissement du gaz de synthèse pour former un gaz de
synthèse
refroidi.
Selon un mode de réalisation, le système est tel que le dispositif de
refroidissement
est un refroidisseur à contact direct.
Selon un autre mode de réalisation, le système comprend en outre un appareil
de
condensation d'eau pour récupérer l'eau du gaz de synthèse refroidi.
Selon un autre mode de réalisation, le système est tel que l'appareil de
condensation est un refroidisseur-condenseur.
12
CA 03166916 2022- 8- 3
WO 2021/243462
PCT/CA2021/050761
Selon un autre mode de réalisation, le système comprend en outre un équipement
pour recycler au moins une partie de l'eau récupérée vers le dispositif de
refroidissement.
BREVE DESCRIPTION DES FIGURES
La Figure 1 représente un schéma du principe général du fonctionnement de la
présente méthode pour produire du syngas.
La Figure 2 représente une vue en coupe selon la verticale d'un réacteur qui
peut
être utilisé pour réaliser la méthode de production de syngas selon un premier
mode de réalisation.
La Figure 3 montre certains paramètres de distance entre les différents flux
et/ou
entre différents éléments du réacteur selon une réalisation de la méthode de
production de syngas.
La Figure 4 représente une vue en coupe selon la verticale d'un réacteur qui
peut
être utilisé pour réaliser la méthode de production de syngas selon un autre
mode
de réalisation.
La Figure 5 représente une vue en coupe selon la verticale d'un réacteur qui
peut
être utilisé pour réaliser la méthode de production de syngas selon un autre
mode
de réalisation.
La Figure 6a représente une vue en coupe selon la verticale d'un réacteur qui
peut
être utilisé pour réaliser la méthode de production de syngas selon un autre
mode
de réalisation. La Figure 6b représente une vue de haut en coupe transversale
du
réacteur de la Figure 6a. Une vue élargie de deux tubes concentriques est
également présentée sur la Figure 6b pour expliquer le paramètre de distance
selon cette réalisation.
La Figure 7 représente un diagramme du processus de production de syngas selon
encore un autre mode de réalisation.
13
CA 03166916 2022- 8- 3
WO 2021/243462
PCT/CA2021/050761
La Figure 8 représente une vue schématique en coupe selon la verticale d'un m
ini-
réacteur utilisé pour les exemples. La figure présente l'arrangement général
des
tubes pour ce mini-réacteur.
DESCRIPTION DÉTAILLÉE
Tous les termes et expressions techniques et scientifiques utilisés ici ont la
même
signification que celle généralement comprise par la personne versée dans
l'art de
la présente technologie. La définition de certains termes et expressions
utilisés est
néanmoins fournie ci-dessous.
Le terme environ tel qu'utilisé dans le présent document signifie
approximativement, dans la région de, et autour de. Lorsque le terme environ
est utilisé en lien avec une valeur numérique, il la modifie, par exemple, au-
dessus
et en dessous par une variation de 10% par rapport à la valeur nominale. Ce
terme
peut aussi tenir compte, par exemple, de l'erreur expérimentale d'un appareil
de
mesure ou de l'arrondissement d'une valeur.
Lorsqu'un intervalle de valeurs est mentionné dans la présente demande, les
bornes inférieures et supérieures de l'intervalle sont, à moins d'indications
contraires, toujours incluses dans la définition.
Les structures chimiques décrites ici sont dessinées suivant les conventions
du
domaine. Aussi, lorsqu'un atome, comme un atome de carbone, tel que dessiné
semble inclure une valence incomplète, alors on assumera que la valence est
satisfaite par un ou plusieurs atomes d'hydrogène même s'ils ne sont pas
explicitement dessinés.
Dans la présente description, les termes gaz de synthèse et syngas
sont
utilisés de manière interchangeable pour identifier un mélange gazeux
comprenant
au moins du monoxyde de carbone (CO) et de l'hydrogène (H2). Dans certaines
réalisations, le gaz de synthèse ou syngas peut comprendre du CO2. Selon une
réalisation, le rapport molaire H2/C0 dans le gaz de synthèse est supérieur ou
égal
14
CA 03166916 2022- 8- 3
WO 2021/243462
PCT/CA2021/050761
1. Dans d'autres réalisations, le gaz de synthèse peut avoir un rapport
molaire
H2/C0 d'au moins 1,8, par exemple compris entre 1,8 et 5,0. Selon une autre
réalisation, le rapport molaire H2/C0 dans le gaz de synthèse est supérieur ou
égal
2. Ainsi, le rapport molaire H2/C0 dans le gaz de synthèse peut être de 1,8 ou
1,9
ou 2,0 ou 2,1 ou 2,2 ou 2,3 ou 2,4 ou 2,5 ou 2,6 ou 2,7 ou 2,8 ou 2,9 ou 3,0
ou 3,1
ou 3,2 ou 3,3 ou 3,4 ou 3,5 ou 3,6 ou 3,7 ou 3,8 ou 3,9 ou 4,0 ou 4,1 ou 4,2
ou 4,3
ou 4,4 ou 4,5 ou 4,6 ou 4,7 ou 4,8 ou 4,9 ou 5,0. Toutefois, des gaz de
synthèse
avec des rapports molaires H2/C0 différents et variés peuvent être obtenus.
Le terme courant est utilisé pour décrire les différents courants gazeux
qui vont
alimenter la chambre de réaction dans laquelle la formation de gaz de synthèse
est réalisée. Comme cela va être décrit plus en détail ci-dessous, la méthode
utilise
au moins un courant contenant de l'hydrogène (H2) et au moins un courant
contenant de l'oxygène (02). La source de carbone utilisée dans la méthode,
selon
sa nature, peut être alimentée soit par un courant indépendant, soit par le
courant
contenant l'02, soit par le courant contenant l'H2. Les courants arrivant dans
la
chambre de réaction sont à l'état gazeux. Si nécessaire, les réactifs à l'état
liquide
peuvent être vaporisés pour qu'ils arrivent dans la chambre de réaction sous
forme
gazeuse.
Le terme flux est utilisé pour décrire les différents flux gazeux qui sont
mis en
jeu pour effectuer la réaction de production du gaz de synthèse, à l'intérieur
de la
chambre de réaction. Comme cela va être décrit plus en détail ci-dessous, la
réaction implique un flux réducteur contenant de l'hydrogène (H2) et la source
de
carbone qui vont réagir entre eux pour former un gaz de synthèse, et un flux
oxydant contenant de l'oxygène (02) qui va réagir avec de l'hydrogène (H2)
pour
former une Oxy-flamme.
Le terme source de carbone décrit le ou les composés chimiques qui sont
utilisés pour fournir le carbone qui se retrouve dans le gaz de synthèse
produit.
Ainsi, la source de carbone fournit au moins le carbone qui se retrouve dans
le
monoxyde de carbone (CO) produit. Différents composés chimiques peuvent être
CA 03166916 2022- 8- 3
WO 2021/243462
PCT/CA2021/050761
Utilisés comme source de carbone. Selon une réalisation, la source de carbone
peut comprendre du CO2. Selon une autre réalisation, la source de carbone peut
comprendre un ou plusieurs types de molécules oxygénées à base de carbone de
formule Cal-IpOy où a est compris entre 1 et 5, i3 est compris entre 2 et 10
et y est
compris entre 1 et 4. La source de carbone peut également comprendre un ou
plusieurs hydrocarbures comme par exemple des alcanes, alcènes et/ou
aromatiques. Il est aussi possible que la source de carbone utilisée pour
produire
le gaz de synthèse soit une combinaison de deux ou plusieurs des différentes
sources décrites ci-dessus. Ainsi, selon certaines réalisations, la source de
carbone peut comprendre du CO2 et une ou des molécules oxygénées de type
CaHr30y. Selon d'autres réalisations, la source de carbone peut comprendre du
CO2 et un ou plusieurs hydrocarbures, par exemple du CO2 et du méthane. Dans
le cas où la source de carbone ne contient que des hydrocarbures, un apport en
atomes d'oxygène sera requis. Cet oxygène peut être fourni par le CO2, mais il
peut aussi être fourni sous forme de vapeur d'eau. Selon certaines
réalisations, la
source de carbone peut comprendre un ou des hydrocarbures, du CO2 et de la
vapeur d'eau. La vapeur d'eau, lorsque requise, peut provenir de la réaction
qui
génère l'Oxy-flamme (voir réaction (G) plus bas) et/ou peut être alimentée
dans la
chambre de réaction.
Le présent document présente donc une méthode innovante pour la production
de gaz de synthèse à partir d'une source de carbone. Comme indiqué
précédemment, la source de carbone peut varier. Dans certaines réalisations,
la
source de carbone comprend du CO2 qui peut généralement provenir de deux
grandes catégories de sources: les sources anthropiques, liées aux activités
humaines et les sources naturelles, dites biogéniques. La présente méthode
peut
utiliser du CO2 provenant de ces deux types de sources et peut également
utiliser
du CO2 pur. Selon une autre réalisation, un mélange gazeux comprenant du CO2
et un ou plusieurs types de molécules oxygénées de formule CaHpOy où a est
compris entre 1 et 5, i3 est compris entre 2 et 10 et y est compris entre 1 et
4 peut
être utilisé. Alternativement, la source de carbone peut simplement comprendre
16
CA 03166916 2022- 8- 3
WO 2021/243462
PCT/CA2021/050761
un ou plusieurs types de molécules CaHpOy. Selon une autre réalisation, un
mélange gazeux comprenant du CO2 et des hydrocarbures, tels que des alcanes
(e.g., du méthane), des alcènes et/ou des molécules aromatiques, peut aussi
être
utilisé. Cependant, il est aussi possible d'utiliser seulement des
hydrocarbures
comme source de carbone. Selon certaines réalisations, la source de carbone
peut
comprendre du 002, un ou plusieurs types de molécules CaHpOy et un ou
plusieurs
types d'hydrocarbures. Un large éventail de molécules organiques, incluant des
produits de source fossile, pouvant contenir éventuellement du soufre, peuvent
être présentes dans le mélange gazeux fournissant la source de carbone.
ir)
Plus particulièrement, la méthode de production de syngas est réalisée en
faisant
réagir la source de carbone avec un excès d'hydrogène au contact d'une Oxy-
flamme. Selon la présente technologie, une Oxy-flamme s'entend d'une
flamme produite par la combustion d'hydrogène en présence d'un oxydant tel que
de l'oxygène (02) selon la réaction (F) suivante :
H2 + 1/2 02 4 H20 (vapeur) + Chaleur (F)
Cette flamme est vive et rayonnante et permet de fournir la chaleur requise
pour
soutenir la réaction qui va produire le gaz de synthèse à partir de la source
de
carbone. Cette flamme peut générer des espèces ioniques et des radicaux libres
qui peuvent catalyser la conversion de la source de carbone en CO. Selon
certaines réalisations, l'Oxy-flamme peut permettre d'atteindre une
température
moyenne, dans la chambre de réaction, au moins d'environ 600 C. Selon d'autres
réalisations, la température moyenne atteinte dans la chambre de réaction est
d'au
moins d'environ 1200 C. La température atteinte dans la chambre de réaction
peut
aller jusqu'à environ 2200 C. Ainsi, la réaction de production du gaz de
synthèse
dans la chambre de réaction, peut être réalisée à une température moyenne d'au
moins 600 C allant jusqu'à environ 2200 C. L'Oxy-flamme peut être qualifiée
d' Oxy-flamme de réduction car la réaction de combustion entre l'hydrogène
et
l'oxygène se fait en présence d'un excès d'hydrogène. Dans un mode de
réalisation, l'oxydant qui est utilisé pour produire l'Oxy-flamme peut être un
17
CA 03166916 2022- 8- 3
WO 2021/243462
PCT/CA2021/050761
mélange à base d'oxygène (02), de préférence de l'oxygène pur. Par oxygène
pur , on comprend que cela ne signifie pas nécessairement une pureté de 100
%, mais que le mélange à base d'oxygène comprend substantiellement de l'02 et
peut être accompagné de certaines impuretés telles que N2, H20 par exemple.
Comme mentionné ci-dessus, la réaction pour former le gaz de synthèse est
réalisée en présence d'un excès d'hydrogène. Par excès d'hydrogène , on
comprendra que la quantité d'hydrogène (H2) doit être suffisante pour d'une
part
permettre la réaction de combustion (F) pour produire l'Oxy-flamme et d'autre
part
pouvoir réaliser la réaction de conversion de la source de carbone en gaz de
synthèse. La quantité d'hydrogène requise pourra être déterminée en fonction
de
la source de carbone utilisée et en tenant compte de la stoechiométrie des
réactions impliquées.
Selon un autre mode de réalisation qui sera expliqué plus en détail ci-
dessous,
l'hydrogène requis dans la présente méthode ainsi que l'oxygène utilisé pour
produire l'Oxy-flamme, peuvent, au moins en partie, résulter d'une réaction
d'électrolyse de l'eau. Ceci peut être d'autant plus avantageux si le système
d'électrolyse de l'eau est alimenté par de l'électricité de source
renouvelable. La
combustion qui permet de produire l'Oxy-flamme peut être initiée à l'aide d'un
dispositif d'allumage, comme par exemple un arc électrique, un fil
incandescent,
ou toute autre source d'énergie connue.
Selon certaines réalisations, la présente méthode peut produire un syngas
contenant essentiellement du H2 et du CO selon un rapport molaire H2/C0 proche
de 2. Selon une réalisation particulière, la présente méthode est adaptée pour
la
production de syngas dont la composition respecte les conditions présentées
par
les équations (D) et (E) reportées ci-dessus. Ceci est rendu possible en
faisant
varier les proportions des différents courants gazeux produisant le flux
oxydant et
le flux réducteur.
18
CA 03166916 2022- 8- 3
WO 2021/243462
PCT/CA2021/050761
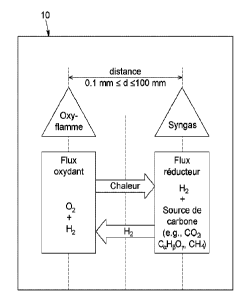
La Figure 1 illustre le principe général du fonctionnement de la méthode. Un
flux
réducteur (à droite sur la figure) comprenant au moins de l'hydrogène et la
source
de carbone se retrouve dans une chambre de réaction (10). La chaleur requise
pour effectuer la conversion de la source de carbone en CO est fournie au
moyen
d'une flamme chaude, appelée Oxy-flamme, laquelle est produite par la
combustion d'hydrogène en présence d'un oxydant tel que de l'oxygène (partie
gauche de la figure). Une partie de l'hydrogène alimenté dans la chambre de
réaction peut être utilisé pour produire l'Oxy-flamme (flèche du bas de la
figure).
Une autre partie de l'hydrogène alimenté dans la chambre de réaction est
utilisée
en tant que telle pour la production du gaz de synthèse. L'Oxy-flamme, en plus
de
fournir la chaleur requise pour la réaction de conversion de la source de
carbone
en CO, peut générer des espèces ioniques et des radicaux libres qui peuvent
favoriser cette conversion. L'hydrogène est introduit en excès dans la chambre
de
réaction et une partie est évacuée avec le CO pour former le syngas.
Globalement,
le processus complet peut être qualifié de processus autotherm igue .
Dans la chambre de réaction (10), on retrouve donc deux flux distincts : un
premier
qui est issu d'un gaz oxydant à base d'oxygène pur appelé flux oxydant, et un
autre
flux, appelé flux réducteur, issu d'un mélange gazeux réducteur à base
d'hydrogène et contenant la source de carbone. Ces deux flux sont à proximités
l'un de l'autre. Selon une réalisation, les deux flux peuvent être séparés par
une
distance d l'un de l'autre telle que 0,1 mm d 100 mm. Selon une autre
réalisation, la distance d séparant les deux flux peut être telle que 0,3 mm d
50
mm. Cette distance peut préférentiellement être telle que 0,6 mm d 30 mm.
Ainsi, la distance d séparant les deux flux peut être de 0,1 mm, 0,2 mm, 0,3
mm,
0,4 mm, 0,5 mm, 0,6 mm, 0,7 mm, 0,8 mm, 0,9 mm, 1 mm, 5 mm, 10 mm, 15 mm,
20 mm, 25 mm, 35 mm, 40 mm, 45 mm, 50 mm, 55 mm, 60 mm, 65 mm, 70 mm,
75 mm, 80 mm, 85 mm, 90 mm, 95 mm, 100 mm, ou n'importe quelle distance
entre ces valeurs. Il est à noter que les flux réducteur et oxydant qui se
retrouvent
dans la chambre de réaction peuvent être issus de courants variés. En effet,
le flux
réducteur provient d'un courant réducteur comprenant au moins du H2 et le flux
19
CA 03166916 2022- 8- 3
oxydant provient d'un courant oxydant comprenant au moins de l'oxygène.
Toutefois, la source de carbone que l'on retrouve dans le flux réducteur dans
la
chambre de réaction, peut être alimentée soit par le courant réducteur, soit
par un
courant indépendant, soit par le courant oxydant si cette source de carbone
.. comprend du CO2 uniquement.
Une première réalisation de la méthode de production du syngas est montrée sur
la Figure 2. Cette réalisation est particulièrement adaptée à la production de
syngas à partir de CO2 comme source de carbone. Un courant comprenant de
l'oxygène (1) est mélangé avec un courant comprenant du CO2 (2) pour produire
un courant oxydant (3) comprenant un mélange d'Oz et de CO2. Le courant
oxydant (3) est acheminé dans un tube (4) permettant l'injection du mélange
d'02
et de CO2 à l'intérieur de la chambre de réaction (10) d'un réacteur. A
l'intérieur de
la chambre de réaction (10), le mélange d'Oz et de CO2 forme un flux oxydant
(6)
dont l'02 va servir à la production de l'Oxy-flamme (9). Un courant comprenant
de
l'hydrogène (5) est injecté à l'intérieur de la chambre de réaction, à travers
un
espace annulaire défini entre la paroi extérieure du tube (4) et la
circonférence
d'une ouverture (7) à l'entrée de la chambre de réaction. Le courant
d'hydrogène
(5) constitue un courant réducteur, qui, une fois à l'intérieur de la chambre,
va
former un flux réducteur qui se divise lui-même en deux parties: une première
partie (8a) du flux réducteur va réagir avec le flux oxydant (6) selon la
réaction de
combustion de l'hydrogène (F) pour produire l'Oxy-flamme (9).
La deuxième partie (8b) du flux d'hydrogène sert d'ingrédient de réactif pour
la
réaction du RWGS (A). La chaleur requise pour cette réaction provient de l'Oxy-
flam me (9).
Les réactions (F) et (A) se produisent à l'intérieur de la chambre de réaction
(10)
pour former un mélange gazeux (12) constitué d'hydrogène, de monoxyde de
carbone, de dioxyde de carbone et de vapeur d'eau. Le mélange gazeux (12) est
aussi nommé syngas humide. Ce mélange gazeux (12) est évacué par l'ouverture
(13) du réacteur.
Date Reçue/Date Received 2023-05-25
WO 2021/243462
PCT/CA2021/050761
Le réacteur utilisé pour cette réalisation comprend une paroi (14) qui peut
être
garnie de matériaux réfractaires et isolants (11). Le volume de la chambre de
réaction (10) est déterminé par l'espace cylindrique défini par la longueur L
et le
diamètre D. Dans le réacteur, la combustion peut être initiée à l'aide d'un
dispositif
d'allumage conventionnel comme par exemple un arc électrique, un fil
incandescent (non montré sur la figure). Selon une réalisation, le réacteur
peut
être équipé d'un dispositif permettant de mesurer la température à l'intérieur
de la
chambre de réaction. Un tel dispositif peut être par exemple un thermocouple
(non
montré dans la figure). Le tube d'injection (4) du courant oxydant (3) peut
être fixé
par le moyen d'un dispositif (15). Selon certaines réalisations, le dispositif
de
fixation (15) peut servir à la fois de guide pour le tube d'injection (4) et
de système
d'étanchéisation. Le dispositif de fixation (15) peut par exemple comprendre
des
brides de serrage avec presse-étoupe.
Selon certaines réalisations, la longueur L de la chambre de réaction peut
être
comprise entre 1 cm et 300 cm, préférentiellement entre 10 cm et 100 cm. Le
diamètre D de la chambre de réaction peut par exemple être compris entre 0.3
cm
et 100 cm, de préférence entre 1 cm et 50 cm. Selon certaines réalisations,
ces
valeurs de longueur et de diamètre de la chambre de réaction peuvent aussi
s'appliquer aux réacteurs présentés dans les Figures 2 à 5.
Selon certaines réalisations, les différents flux gazeux peuvent être
caractérisés par
certains paramètres qui vont être définis ci-après. Certains de ces paramètres
dépendent de différentes distances qui sont montrées par exemple dans la
Figure 3.
Le flux oxydant (6) peut être caractérisé par un paramètre de vitesse v1 selon
l'équation (G) suivante:
V1 = V1/ ((rr/4)*DiA2) (G)
où V1 correspond au débit volumique du courant oxydant (3) aux conditions de
température et de pression dans la chambre de réaction, et Di est le diamètre
21
CA 03166916 2022- 8- 3
WO 2021/243462
PCT/CA2021/050761
intérieur du tube d'admission (4) du courant oxydant (3). Dans les équations,
le
symbole = signifie multiplié et le symbole "2 signifie au carré
.
Le diamètre Di est tel que la vitesse v1 caractérisant le flux oxydant (6) est
d'au
moins 1 m/s, en se basant sur le débit volumique V1. Selon une autre
réalisation,
le diamètre Di est tel que la vitesse v1 se situe entre 5 m/s et 150 m/s,
préférentiellement entre 5 et 100 m/s. La vitesse v1 peut donc être par
exemple
comprise entre 5 m/s et 90 m/s, entre 5 m/s et 80 m/s, entre 5 m/s et 70 m/s,
entre
5 m/s et 60 m/s, entre 5 m/s et 50 m/s, entre 5 m/s et 40 m/s, entre 5 m/s et
30
m/s, entre 5 m/s et 20 m/s, ou entre 5 m/s et 10 m/s.
Le flux du courant réducteur (8a, 8b) est caractérisé par un paramètre de
vitesse
v2 selon l'équation (H) suivante:
v2 = V2 / ((-rr/4)=(DA2-D'iA2)) (H)
où V2 est le débit volumique du courant réducteur (8a, 8b) aux conditions de
température et de pression dans la chambre de réaction, D est le diamètre
interne
du réacteur et D'i est le diamètre externe du tube d'admission (4) du courant
oxydant (3).
L'ouverture (7) caractérisée par (D/2-D'i/2) peut être telle que la vitesse v2
du
courant réducteur circulant dans l'espace annulaire défini entre la paroi
externe du
tube (4) et la circonférence de l'ouverture (7), sera d'au moins 1 m/s en se
basant
sur le débit volumique V2. Selon une autre réalisation, l'ouverture (7) (D/2-
D'i/2)
est telle que la vitesse v2 se situe entre 5 m/s et 150 m/s,
préférentiellement entre
10 et 100 m/s. La vitesse v2 peut donc être par exemple comprise entre 10 m/s
et
90 m/s, entre 10 m/s et 80 m/s, entre 10 m/s et 70 m/s, entre 10 m/s et 60
m/s,
entre 10 m/s et 50 m/s, ou entre 10 m/s et 40 m/s.
Selon certaines réalisations, il est possible de définir un paramètre pour
caractériser le niveau de proximité entre le flux réducteur (8a, 8b) et le
flux
22
CA 03166916 2022- 8- 3
produisant l'Oxy-flamme (9). Ce paramètre peut être défini par la distance d
selon
l'équation (I) suivante :
d= (D ¨ )/4 (I)
Comme indiqué précédemment, la distance d peut être comprise entre 0,1 mm et
100 mm, de préférence entre 0,3 mm et 50 mm, et préférentiellement entre 0,6
mm et 30 mm. La distance d peut aussi être n'importe quelle distance comprise
dans ces gammes de valeurs.
Selon un mode de réalisation, le volume de la chambre de réaction (10) du
réacteur va permettre un certain temps de séjour de tous les réactifs à
l'intérieur
de la chambre de réaction (10) d'au moins 0,01 seconde. Ce temps de séjour
peut
être défini selon l'équation (J) suivante :
t= ((rr/4).DA2-eL) / (V1 +V2) (J)
où L est la longueur de la chambre de réaction (10), i.e., la longueur du
volume
intérieur du réacteur tel que montré par exemple sur la Figure 2.
Selon certaines réalisations, V1 peut être compris entre 2 Umin (3,33E-5 m3/s)
et
100000 L/min (1,67 m3/s), de préférence entre 5 Umin (8,33E-05 m3/s) et 50000
Um in (0,84 m3/s). Selon certaines réalisations, V2 peut être compris entre 10
L/min
(1,67E-04 m3/s) et 300000 L/min (5 m3/s), de préférence entre 25 L/min (4,17E-
04
m3/s) et 200000 Umin (3,33 m3/s).
Selon certaines réalisations, la méthode pour produire le syngas peut être
réalisée
en utilisant un ratio molaire H2/CO2 compris entre 2 et 7. Le ratio molaire
02/CO2 peut par exemple être compris entre 0,35 et 0,9. La production de
syngas
peut être réalisée en utilisant par exemple un ratio molaire 02/H2 compris
entre 0,1
et 0,3.
23
Date Reçue/Date Received 2023-05-25
WO 2021/243462
PCT/CA2021/050761
Selon certaines réalisations, la méthode pour produire le syngas peut être
réalisée
en utilisant les proportions molaires suivantes des différents réactifs :
= ratio molaire H2/CO2 compris entre 2 et 7; et
= ratio molaire 02/CO2 compris entre 0,35 et 0,9; et
= ratio molaire 02/H2 compris entre 0,1 et 0,3.
La température atteinte à l'intérieur de la chambre de réaction lors de la
production
du syngas peut être d'au moins 600 C. Cette température peut être d'au plus
2200 C. On comprendra que la température peut donc varier entre une valeur de
600 C et de 2200 C, et peut donc être par exemple de 1000 C, 1100 C, 1200 C,
1300 C, 1400 C, 1500 C, 1600 C, 1700 C, 1800 C, 1900 C, 2000 C, 2100 C et
2200 C ou n'importe quelle température comprise entre ces valeurs. On comprend
qu'à l'intérieur de la chambre de réaction, un profil de température s'établit
pendant
la réaction. Ainsi, la température n'est pas nécessairement la même à un point
précis par rapport à un autre point à l'intérieur de la chambre de réaction.
En
d'autres termes, il y a des endroits plus chauds et d'autres moins chauds à
l'intérieur de la chambre de réaction. Lorsqu'on parle de la température
atteinte
dans la chambre de réaction, il est donc question d'une température moyenne
représentative.
La température peut varier en fonction de la pression dans la chambre de
réaction
pendant la réaction de production de syngas. La pression pour réaliser la
réaction
de production du syngas peut être d'au moins 0,5 atm. Selon certaines
réalisations, la production du syngas peut être effectuée à une pression d'au
plus
3 atm. Selon certaines réalisations, la pression peut donc être de 0.5 atm, 1
atm,
1,5 atm, 2 atm, 2,5 atm ou de 3 atm, ou encore n'importe quelle pression
comprise
entre ces valeurs. Par exemple, la pression peut être comprise entre 1 atm et
3
atm.
24
CA 03166916 2022- 8- 3
Dans certaines réalisations, pour un débit donné de CO2 et de H2, le débit
d'alimentation d'Oz peut être ajusté de manière à obtenir un niveau désiré de
température et de chaleur à l'intérieur du réacteur pour opérer la réaction du
RWGS. D'autre part, le débit de H2 peut être ajusté de manière à obtenir le
rapport
H2/C0 ou le rapport R2 défini par l'équation (E) que l'on désire avoir pour le
mélange gazeux (12) évacué par l'ouverture (13).
La Figure 4 présente une autre réalisation possible de la méthode de
production
de syngas et d'un réacteur pouvant être utilisé pour cette production. Cette
réalisation est adaptée à la production de syngas à partir de toute source de
carbone possible. Dans ce cas-ci, un courant comprenant une source de carbone
(2) est mélangé avec un courant d'hydrogène (5a) pour former un courant
réducteur (5b) qui est ensuite envoyé dans le réacteur. Même si la source de
carbone comprend du CO2 qui est un oxydant, le mélange (5b) formé par mélange
du gaz comprenant le CO2 et l'hydrogène, est toutefois un mélange réducteur
puisqu'il est majoritairement constitué d'hydrogène. Selon certaines
réalisations,
la source de carbone est du CO2 et le rapport molaire H2/CO2 dans le courant
réducteur peut être d'au moins environ 2, et préférablement au moins 3. Une
fois
dans la chambre de réaction (10), le courant réducteur (5b) devient le flux
réducteur (8a, 8b). Un courant oxydant comprenant de 1'02 (1) est acheminé
dans
le réacteur au moyen du tube (4) pour former le flux oxydant (6). Une première
partie (8a) du flux réducteur réagit avec le flux oxydant (6) pour produire
l'Oxy-
flamme (9). La deuxième partie (8b) du flux d'hydrogène qui contient aussi la
source de carbone réagit en utilisant la chaleur provenant de l'Oxy-flamme
(9).
Étant donné que le flux (8b) comprend un excès d'hydrogène, le mélange gazeux
(12) qui est formé en sortie du réacteur est constitué d'hydrogène, de
monoxyde
de carbone, de dioxyde de carbone et de vapeur d'eau. Ce courant gazeux, ou
syngas humide, est évacué par l'ouverture (13) du réacteur.
Date Reçue/Date Received 2023-05-25
WO 2021/243462
PCT/CA2021/050761
Selon une réalisation, la source de carbone formant le courant (2) peut
comprendre essentiellement du CO2 et la réaction qui se produit dans la
chambre
de réaction est la réaction RVVGS (A).
Selon une autre réalisation, la source de carbone formant le courant (2) peut
comprendre des molécules organiques de formule chimique CalipOy où a peut
varier entre 1 et 5, 13 peut varier entre 2 et 10 et y peut varier entre 1 et
4. D'autres
types de molécules organiques peuvent également former le courant (2), comme
des hydrocarbures tels que des alcanes (e.g., méthane), des alcènes, des
aromatiques. Ces molécules organiques peuvent éventuellement être en mélange
ir) avec du CO2 dans le courant (2).
Lorsque la source de carbone comprend des molécules organiques de type
CaHp0y, les réactions suivantes peuvent se produire dans la chambre de
réaction :
= Formation de syngas selon l'équation (K) :
CaHpOy + a' H2 Q c H2 + d CO + e' H20 + f CO2 (K)
= Combustion d'hydrogène selon l'équation (L) :
a" H2 + b 02 e" H20 + Q (L)
où a', a", b, c, d, e', e" et f sont des coefficients stoechiométriques dont
les
valeurs dépendent des molécules en jeu et des conditions de fonctionnement
considérées pour réaliser la production de gaz de synthèse, et Q est la
chaleur
impliquée dans le processus.
Avec a = a' + a" et e = e'+ e", la somme des équations (K) et (L) donne donc
l'équation stoechiométrique (M) suivante :
CaHpOy + a H2 + b02 C H2 + d CO + e H20 + f CO2 (M)
Les coefficients stoechiométriques peuvent être déterminés en partant de la
formule chimique du composé organique utilisé comme source de carbone.
26
CA 03166916 2022- 8- 3
Par exemple, pour a = 1, les coefficients peuvent avoir les valeurs suivantes
:
= a entre 1 et 5
= a" entre 0,5 et 2
= b entre 0,25 et 1
= c entre 2 et 3
= d entre 0,5 et 1
= e entre 0,5 et 2,5
= e" entre 0,5 et 2
= f entre 0,15 et 0,75.
Comme mentionné ci-dessus, le courant (2) peut comprendre un mélange de CO2
et de molécules organiques de formule CaHpOy. Dans ce cas, les deux réactions
(A) et (M) peuvent se produire dans la chambre de réaction pour former le
syngas.
Lorsque la source de carbone comprend un hydrocarbure, la production de syngas
peut s'effectuer dans la chambre de réaction en présence d'un oxydant pour
permettre l'oxydation de l'hydrocarbure. Un tel oxydant peut comprendre de la
vapeur d'eau et/ou du CO2. La vapeur d'eau peut être générée par la réaction
(F)
de combustion d'H2 lors de la formation de l'Oxy-flamme et/ou peut être
alimentée
indépendamment dans la chambre de réaction.
Si la source de carbone comprend du méthane comme hydrocarbure, les réactions
suivantes peuvent se produire dans la chambre de réaction, selon l'oxydant mis
en jeu (vapeur d'eau, CO2):
CH4 + H20 CO +3 H2 (N)
CH4 + CO2 2 CO + 2 H2 (0)
Si la source de carbone comprend un hydrocarbure de formule CnHrn, la réaction
suivante peut se produire dans la chambre de réaction :
CnHrn n H20 n CO + (n + 1/2 m) H2 (P)
27
Date Reçue/Date Received 2023-05-25
WO 2021/243462
PCT/CA2021/050761
Ainsi, la présente méthode de production de syngas offre la possibilité
d'utiliser
des sources de carbone variées. Par exemple, la source de carbone peut être un
mélange gazeux produit par des procédés industriels tels que des procédés de
gazéification ou de pyrolyse de biomasses.
II est à noter que les différents paramètres de réaction mentionnés ci-dessus
en
relation avec la Figure 3 (pression, température, distance, diamètres,
vitesses,
débits volumétriques, temps de séjour, etc.) peuvent également s'appliquer au
mode de réalisation impliquant les différentes sources de carbone qui vient
d'être
présenté en relation avec la Figure 4.
La Figure 5 présente une autre réalisation de la méthode de production de
syngas
et d'un réacteur utilisable, entre autres, pour cette réalisation. Comme pour
la
réalisation présentée en Figure 4, celle de la Figure 5 est adaptée à la
production
de syngas à partir de toute source de carbone possible (e.g., CO2, molécules
de
formule Cal-430y, hydrocarbures ou leurs mélanges). Tel que montré sur la
Figure
5, l'Oxy-flamme (9) peut être produite par injection d'oxygène et d'hydrogène
au
moyen de deux tubes concentriques distincts (4a et 4b), comme cela va être
expliqué plus en détail ci-dessous. Dans cette réalisation, le réacteur
comprend
dans sa partie inférieure un tube central (4a) qui s'insère dans un second
tube de
diamètre plus large (4b). Le tube central (4a) peut être fixé au tube plus
large (4b)
au moyen d'un dispositif de fixation (15b) tel un dispositif d'étanchéisation.
Le
second tube plus large (4b) peut lui-même être fixé à la paroi (14) du
réacteur au
moyen d'un dispositif de fixation (15a) qui est de préférence similaire au
dispositif
de fixation (15b). L'intérieur du réacteur est divisé en deux compartiments
(10a et
10b). Les deux compartiments (10a, 10b) sont séparés par une paroi (16) munie
d'une ouverture (7b). Le premier compartiment (10a) constitue la chambre de
réaction du réacteur.
Comme on peut le voir sur la Figure 5, un courant oxydant (1) à base d'oxygène
est injecté dans le tube central (4a), alors qu'un courant comprenant de
l'hydrogène (5) est injecté dans le second tube (4b). Le courant d'hydrogène
(5)
28
CA 03166916 2022- 8- 3
WO 2021/243462
PCT/CA2021/050761
passe au travers d'une ouverture définie par l'espace annulaire (7a) entre la
paroi
intérieure du tube médian (4b) et la paroi extérieure du tube central (4a). Un
courant (2) comprenant une source de carbone est injecté à l'intérieur du
compartiment (10b) qui peut être qualifié de chambre de distribution, et passe
ensuite au travers de l'ouverture (7b) pour pénétrer dans la chambre de
réaction
(10a). Dans le réacteur, le courant de 02 (1) devient un flux oxydant (6), le
courant
de H2 (5) devient un flux d'hydrogène (8c) et le courant (2) comprenant la
source
de carbone se retrouve dans un troisième flux (8d). Le flux d'oxygène (6) et
une
partie du flux d'hydrogène (8c) servent à la production de l'Oxy-flamme (9),
alors
que l'hydrogène en excès, i.e. qui n'est pas brûlé, vient réagir avec le flux
comprenant la source de carbone (8d). On comprend que, même si directement à
l'entrée de la chambre de réaction, on aura bien un flux (8c) d'112 distinct
d'un flux
(8d) comprenant la source de carbone, ces deux flux (8c) et (8d) ne
constituent
plus des flux totalement séparés dès qu'ils pénètrent dans la chambre de
réaction,
et qu'ils peuvent alors chacun comprendre à la fois du H2 et la source de
carbone
une fois dans la chambre de la réaction.
Dans le mode de réalisation illustré à la Figure 5, le courant comprenant la
source
de carbone (2) peut être du CO2. Cependant, le courant (2) peut aussi
comprendre
d'autres composés comme les molécules organiques et/ou hydrocarbures tels que
décrits ci-dessus tout en étant exempt de CO2. En outre, selon certaines
réalisations, le courant (2) peut aussi comprendre de l'hydrogène. Ainsi, une
certaine quantité d'hydrogène peut être alimentée dans le tube médian (4b)
pour
servir à former le flux d'hydrogène (8c) alors qu'une autre partie d'hydrogène
peut
être mélangée avec du CO2 et/ou des vapeurs organiques et/ou d'hydrocarbure
pour former le flux (8d).
Il est à noter que les différents paramètres de réaction mentionnés ci-dessus
en
relation avec la Figure 3 (pression, température, vitesses, diamètres, débits
volumétriques, temps de séjour, etc.) peuvent également s'appliquer au mode de
réalisation impliquant les différentes sources de carbone qui vient d'être
présenté
en relation avec la Figure 5.
29
CA 03166916 2022- 8- 3
WO 2021/243462
PCT/CA2021/050761
Les Figures 6a et 6b présentent un mode de réalisation de la méthode de
production de syngas utilisant un réacteur de grande capacité. Comme pour la
réalisation présentée en relation avec la Figure 2, la réalisation des Figures
6a et
6b est particulièrement adaptée à la production de syngas à partir de CO2
comme
source de carbone. Selon ce mode de réalisation, le réacteur peut comprendre
une paroi (14) et un matériau isolant et réfractaire (11) pour protéger la
chambre
de réaction (10a). Une chambre de distribution (10b) est disposée dans la
partie
inférieure du réacteur en communication avec la chambre de réaction (10a). La
chambre de distribution reçoit le courant réducteur (5) comprenant de
l'hydrogène
avant qu'il pénètre dans la chambre de réaction. La chambre de réaction (10a)
est
séparée de la chambre de distribution du courant réducteur (10b) par une
paroi.
La paroi peut être constituée de matériau réfractaire avec isolant et être
soutenue
par une plaque (16). La plaque (16) peut par exemple être une plaque
métallique.
Le compartiment (10b) peut être traversé par une multitude de tubes
concentriques (4) qui peuvent être fixés à la paroi (14) du réacteur dans la
partie
inférieure du compartiment (10b). Les tubes (4) peuvent être fixés à la paroi
(14)
au moyen d'un dispositif d'étanchéisation (15). Les dispositifs de fixation et
d'étanchéisation (15) peuvent également servir de guides pour maintenir la
position des tubes (4). Les tubes concentriques (4) s'étendent à travers la
chambre
de distribution (10b) jusque dans la partie inférieure de la chambre de
réaction
(10a) pour former une multitude de ports d'entrée (7b) par lesquels le courant
oxydant (3) est injecté dans la chambre de réaction. De plus, la paroi entre
la
chambre de distribution et la chambre de réaction est munie d'ouvertures
formant
une multitude de ports d'entrée (7a) de rayon ri par lesquels le courant
réducteur
(5) peut pénétrer à l'intérieur de la chambre de réaction. Selon une
réalisation
préférée, les ouvertures (7a) forment un anneau autour des tubes (4) comme on
peut le voir sur la Figure 6b. Les ports d'entrées (7b) de rayon r2 peuvent
être
concentriques par rapport aux ports d'entrées (7a). Le courant réducteur (5)
peut
être injecté dans la chambre de distribution (10b) par plus d'un port
d'entrée. Sur
la Figure 6b, on voit que le réacteur peut être muni d'au moins 4 ports
d'entrée
pour le courant réducteur (5). De plus, tel que montré par la figure 6a, le
réacteur
CA 03166916 2022- 8- 3
WO 2021/243462
PCT/CA2021/050761
peut comprendre une multitude de tubes (4) pour injecter le courant oxydant
(3)
dans la chambre de réaction (10a). Finalement, le réacteur selon cette
réalisation
comprend aussi une sortie (13) pour permettre l'évacuation du syngas produit
dans la chambre de réaction.
Selon cette réalisation, plusieurs Oxy-flammes peuvent se former dans la
chambre
de réaction. Le paramètre de distance entre le flux réducteur et le flux
oxydant
(Oxy-flamme) pour cette réalisation peut être défini comme suit :
d = (ri -r2)/2 (0)
Comme pour l'ensemble des réalisations, la distance d peut être comprise de
préférence entre 0,1 mm et 100 mm. Selon une autre réalisation, la distance d
séparant les deux flux peut être comprise entre 0,3 mm et 50 mm, ou encore
préférentiellement entre 0,6 mm et 30 mm. La distance d peut aussi être
n'importe
quelle distance comprise dans ces gammes de valeurs.
Comme mentionné plus haut, selon certaines réalisations, l'hydrogène dont on a
besoin dans le courant réducteur et qui est utilisé pour obtenir le syngas,
peut être
produit à partir de ressources renouvelables. Notamment, l'hydrogène peut être
produit à partir d'un système d'électrolyse de l'eau alimenté par de
l'électricité
issue de sources renouvelables. Le courant comprenant la source de carbone
(e.g.
CO2) dont on a aussi besoin comme réactif, peut être lui-même un mélange
gazeux issu de techniques de gazéification ou de pyrolyse de biomasses, comme
cela a été mentionné ci-dessus. Ainsi, globalement, il est possible de
produire des
gaz de synthèse à partir d'une source de carbone captée, d'eau et
d'électricité de
sources renouvelables.
Cette réalisation de la méthode de production de syngas à partir de ressources
renouvelables est représentée sur une partie de la Figure 7. La Figure 7
montre
également des étapes additionnelles, comprenant par exemple la récupération
d'eau formée pendant la réaction de production du gaz de synthèse. Ainsi, la
Figure 7 présente les étapes suivantes:
31
CA 03166916 2022- 8- 3
WO 2021/243462
PCT/CA2021/050761
= électrolyse (20) de l'eau alimentée (H20-a) par de l'électricité de
source
renouvelable (E);
= production de syngas (30) selon l'une des réalisations décrites
précédemment;
= refroidissement des gaz produits (40), par exemple au moyen d'un
refroidissement par contact direct;
= récupération d'eau (H20-c) par condensation (50).
Plus particulièrement, comme on peut le voir sur la Figure 7, le système
d'électrolyse (20) est alimenté avec de l'eau (H20-a) pour produire de
l'hydrogène
(H2) et de l'oxygène. L'hydrogène (H2) produit par l'électrolyse est mélangé
avec
un gaz comprenant du CO2 et/ou une autre source carbone, préférentiellement du
002. Ce gaz comprenant du CO2 et/ou une autre source carbone, peut provenir,
au moins en partie, d'un procédé de gazéification ou de pyrolyse de biomasse.
Le
mélange obtenu (GO) forme un courant réducteur qui peut ensuite être utilisé
pour
la production de syngas (30). Une partie de l'oxygène (02-a) produit par
l'électrolyse (20) est envoyée vers la production de syngas (30), où il peut
être
utilisé pour générer l'Oxy-flamme. L'autre partie de l'oxygène (02-b) produit
par
l'électrolyse (20) peut être évacuée.
Le gaz (G1) résultant de la production de syngas (30) est ensuite refroidi
(40)
rapidement afin de limiter/éviter que se produise la réaction inverse de la
réaction
(A). Le refroidissement peut être effectué en utilisant une méthode
conventionnelle. Selon une réalisation préférée, le refroidissement (40) peut
être
réalisé au moyen d'un refroidisseur à contact direct avec un courant d'eau
(H20-
b). Selon une réalisation, le gaz (G1) est refroidi à une température
supérieure au
point de rosée du gaz chaud et n'excédant pas 250 C. Selon certaines
réalisations, le point de rosée du gaz chaud (G1) est inférieur à 90 C à
pression
atmosphérique. Par exemple, le point de rosée du gaz chaud (G1) est compris
32
CA 03166916 2022- 8- 3
WO 2021/243462
PCT/CA2021/050761
entre 60 C et 90 C à pression atmosphérique. Selon certaines réalisations, le
gaz
(G1) peut être refroidi à une température comprise entre 90 C et 250 C.
Le gaz refroidi (G2) obtenu à l'issue du refroidissement (40) est un gaz
humide.
Ce gaz (G2) peut ensuite subir un deuxième refroidissement qui peut être
effectué
par condensation (50). Selon certaines réalisations, cette condensation peut
être
réalisée en utilisant un refroidisseur-condenseur. Selon une réalisation
préférée,
l'étape de condensation (50) peut être effectuée de telle manière à ce que le
gaz
(G2) soit refroidi jusqu'à une température de 35 C et moins. A la sortie du
refroidisseur-condenseur, on obtient d'une part le syngas (G3) et d'autre part
de
l'eau condensée (H20-c). Une partie de l'eau condensée (H20-c) peut être
recyclée (écoulement H20-b) à l'étape de refroidissement (40) alors que
l'autre
partie de l'eau condensée peut être évacuée (écoulement H20-d). Selon
certaines
réalisations, l'écoulement H20-d peut être utilisé, au moins en partie, pour
alimenter en eau le système d'électrolyse (20).
Comme cela a été mentionné précédemment, la méthode de production de syngas
décrite dans le présent document peut permettre de produire des mélanges
gazeux à base de CO et de H2 (syngas) qui sont balancés, i.e., avec des
proportions de CO et H2 appropriées, pour ensuite permettre la production
d'une
variété de produits par des synthèses chimiques conventionnelles. Ainsi, il
est
possible en contrôlant la nature et la quantité de réactifs utilisés (e.g., le
débit des
courants gazeux), de produire un syngas où la proportion de CO et H2 est
adaptée
pour que le mélange soit directement utilisable dans une synthèse chimique
ultérieure. Il est également possible de jouer sur la proportion de CO et H2
dans le
syngas, en contrôlant la température, la pression et le débit d'alimentation
d'02
dans la chambre de réaction. En outre, la température dans le réacteur peut
être
contrôlée par le débit d'oxygène alimenté. Selon un mode de réalisation, le
syngas
produit contient du H2 et du CO dans un rapport molaire H2/C0 2. Le syngas
produit par la méthode décrite peut aussi contenir du CO2. Dans ce cas, les
ratios
molaires du H2, CO et CO2 dans le syngas peuvent être tels que (H2-002) / (CO
+
002) 2.
33
CA 03166916 2022- 8- 3
WO 2021/243462
PCT/CA2021/050761
En respectant ces ratios molaires, le syngas produit par la présente méthode
peut
être utilisé pour produire un grand nombre de produits chimiques de base.
Parmi
ces produits, on retrouve notamment le méthanol et les hydrocarbures tels que
ceux qu'on retrouve dans l'essence à moteur, le diesel, le kérosène, pour
nommer
quelques exemples.
La méthode de production de syngas décrite ci-dessus et le réacteur que l'on
peut
utiliser pour réaliser cette méthode présentent donc plusieurs avantages. Les
réactifs sont facilement accessibles et peuvent dériver de sources
renouvelables.
Il n'est pas nécessaire d'avoir recours à l'utilisation de catalyseurs
solides. Le taux
de conversion des réactifs peut également être supérieur au taux de conversion
observé dans le cas d'une réaction R\NGS réalisée de manière conventionnelle
en présence de catalyseur. Enfin, la présente méthode est caractérisée par sa
robustesse, en ce qu'elle est versatile et simple à mettre en oeuvre. Ces
avantages
permettent donc de diminuer les coûts de production en plus de l'effet
environnemental bénéfique de recycler des sources de carbone comme le CO2
par exemple.
EXEMPLES
Exemple 1
Cet exemple s'appuie sur un réacteur de petite taille tel que représenté
schématiquement sur la Figure 8. Ce mini-réacteur fonctionne selon un scénario
impliquant la co-injection d'02 et CO2 pré-mélangés, à l'intérieur du tube
interne,
i.e., dans l'espace A, et injection de H2 dans l'espace annulaire B. Le
réacteur a
été construit à partir de petits tubes en Inconel 600Tm. Les dimensions
suivantes
sont utilisées pour caractériser la géométrie du mini-réacteur (D.I. =
diamètre
interne; D.E. = diamètre externe) où L correspond à une longueur à partir du
début
de la zone de réaction (dimensions en mm):
= Tube externe : D.I. = 10,41; D.E. = 12,7; L =
371,83
= Tube médian : D.I. = 7,752; D.E. = 9,53; L 0
(début de la zone de réaction)
34
CA 03166916 2022- 8- 3
WO 2021/243462 PCT/CA2021/050761
= Tube interne D.I. = 3,048; D.E. = 6,35; L 0
(début de la zone de réaction)
Un système d'allumage servant à l'ignition d'un pulsoréacteur, i.e., une
bougie
d'allumage avec ignition à 20 kV, a été inséré à l'intérieur du réacteur, tout
près de
l'extrémité supérieure des tubes interne et médian. Une perforation a été
effectuée
pour permettre d'introduire la bougie d'allumage (non montré dans la figure
pour
fins de clarté). L'évolution du niveau de température dans le réacteur est
suivie à
l'aide de thermocouples. La température est mesurée dans une partie basse et
aussi dans une partie haute de la zone de réaction à l'intérieur du mini-
réacteur.
Autrement dit, une lecture de la température près de la base de la zone de
réaction
(où les gaz sont injectés) plus précisément 13 mm plus haut que la ligne du
début
de la zone de réaction (voir figure 8) et une autre lecture à 89 mm plus haut
que
la ligne du début de la zone de réaction (voir figure 8), sont réalisées. Les
thermocouples ont été installés par le moyen de raccords en T (non montrés par
la figure).
Le montage expérimental comprend ce qui suit: le réacteur proprement dit, un
échangeur de chaleur à tube et jaquette permettant un refroidissement rapide
des
gaz sortant du réacteur, un réservoir de récupération du condensat, un système
d'analyse d'humidité relative (RH) des gaz, et enfin, un système d'analyse
(CO2/CO/CxHy/02) permettant de mesurer les teneurs en CO, CO2, hydrocarbures
(CH) ainsi que la teneur en oxygène du gaz produit, à la sortie du système de
refroidissement des gaz.
Un système de débitmètres massiques avec vannes de contrôle automatisées est
également mis en place. Le système est accompagné d'un logiciel permettant de
programmer des changements de composition du mélange de gaz introduit dans
le réacteur. Finalement, des valves manuelles sont utilisées afin de diriger
chacun
des gaz dans le tube du réacteur désiré.
Pour éviter les retours de flammes à l'allumage, l'allumage est réalisé par
paliers
(d'une durée d'environ 1 seconde). Les principales étapes de la séquence
CA 03166916 2022- 8- 3
WO 2021/243462
PCT/CA2021/050761
d'allumage comprennent: 1) débuter l'injection de H2, 2) après quelques
secondes,
injecter l'oxygène par paliers successifs jusqu'au débit désiré, chaque palier
étant
d'une durée de quelques secondes, 3) débuter l'injection du CO2.
Une fois que l'allumage se produit, on peut procéder aux paliers d'analyse en
tant
que tels. Chacun de ces paliers a une durée de 60 secondes. Après ce laps de
temps, on procède aux différentes mesures. Les débits des intrants (litres
standard
(SL) à 25 C, 1 atm par min) sont les suivants :
= CO2: 1,3 SL/min
= 02: 0,93 SL/min
- H2 :6,1 SL/min
Les débits de CO2 et 02 sont pré-mélangés. La pression de fonctionnement est
de
près de 1 atm.
Les résultats suivants ont été obtenus :
= Concentration molaire en CO du gaz: 22.2 %
= Concentration molaire en CO2 du gaz: 8,1 %
= Concentration molaire en hydrocarbure : trace
= Ratio molaire CO/CO2 du gaz produit : 2,74
= Taux de conversion de CO2 en CO: 73 %
= Température moyenne dans la chambre de réaction : 686 C
= Vitesse à l'entrée du mélange 02/CO2 (à température moyenne, 1 atm) : 16,4
m/s
= Vitesse à l'entrée de H2 (à température moyenne) : 21,1 m/s
= Temps de séjour dans le réacteur (s) : <0,06 s
= Rapport R2 = (H2-0O2) / (CO+CO2): 2,26
Pour le calcul du rapport R2, la concentration de H2 est calculée à partir
d'un bilan
atomique. Le bilan atomique est lui-même effectué en tenant compte de tous les
intrants (CO2, H2, 02) et en tenant compte de la composition du gaz sortant
(teneurs en CO et CO2, teneur en hydrocarbures exprimée en équivalent CI-14,
36
CA 03166916 2022- 8- 3
WO 2021/243462
PCT/CA2021/050761
humidité du gaz, teneur en oxygène résiduel). Le bilan atomique sur les atomes
d'hydrogène permet de calculer la composition en hydrogène du gaz à la sortie
du
réacteur.
Exemple 2
Dans cet exemple, le même dispositif que pour l'exemple 1 est utilisé, mais
avec
injection de 02 dans le tube interne (espace A), injection de H2 dans l'espace
annulaire entre le tube médian et le tube interne (espace B), et injection
d'un
mélange équimolaire CO2/CH4 dans l'espace annulaire entre le tube externe et
le
tube médian (espace C). Les débits des intrants (litres standard à 25 C, 1
atm par
min) sont les suivants :
= CO2: 0,40 SL/min
= CH4: 0,40 SL/min
= 02: 0,9 SL/min
= H2: 3,3 SL/min
Ces trois écoulements sont injectés séparément dans le mini-réacteur. Les
résultats suivants ont été obtenus :
= Concentration en CO du gaz sec: 13,3 (:)/0
= Concentration molaire en CO2 du gaz: 10,2 %
= Concentration molaire en hydrocarbure du gaz : 2135 ppm
= Ratio CO/CO2 du gaz produit : 1,30
= Taux de conversion de CO2: 13,1 %
= Taux de conversion du CH4 : 98.2 %
= Température moyenne : 855 C
= Vitesse à l'entrée de 02 (à température moyenne, 1 atm) : 7,77 m/s
= Vitesse à l'entrée du H2 (à température moyenne, 1 atm) : 13,4 m/s
= Vitesse à l'entrée du mélange CO2/CH4 (à température moyenne,1 atm) :
7,46 m/s
= Temps de séjour des réactifs : <0,07 s
= R2 = (H2-0O2) / (CO+CO2) : 2,87
37
CA 03166916 2022- 8- 3
WO 2021/243462
PCT/CA2021/050761
Pour le calcul du rapport R2, la concentration de H2 est calculée à partir
d'un
bilan atomique.
Exemple 3
Dans cet exemple, le même réacteur que celui de l'exemple 1 est utilisé, mais
le
tube externe en lnconelTM est remplacé par un tube de quartz. La longueur de
la
chambre de réaction est la même. Pour cet exemple, les débits de CO2 et 02
sont
pré-mélangés. Le mélange obtenu est injecté à l'intérieur du tube interne
(espace
A), alors que l'hydrogène est injecté à l'intérieur de l'espace B. La pression
de
fonctionnement est de près de 1 atm. La température ne pouvant être mesurée
directement, la température utilisée est une valeur de température d'équilibre
thermodynamique calculée pour l'obtention d'un gaz présentant le même rapport
CO/CO2 que ce qui a été mesuré.
Les débits des intrants (litres standard à 25 C,1 atm par min) sont les
suivants :
= CO2: 1,3 SL/min
= 02: 0,93 SL/min
= H2 : 6,2 SL/min
Les résultats suivants ont été obtenus :
= Concentration en CO du gaz: 22.9 (:)/0
= Concentration en CO2 du gaz: 7,30 %
= Concentration molaire en hydrocarbure : trace
= Ratio CO/CO2 du gaz produit : 3,14
= Taux de conversion de CO2 en CO: 75,8 %
= Température d'équilibre T: 1230 C
= Vitesse à l'entrée du mélange 02/CO2 (à température T,1 atm) : 25,6 m/s
= Vitesse à l'entrée du H2 (à température T et 1 atm) : 33,7 m/s
= Temps de séjour des réactifs : <0,04 s
= R2 = (H2-0O2) / (CO+CO2) : 2,34
38
CA 03166916 2022- 8- 3
WO 2021/243462
PCT/CA2021/050761
Pour le calcul du rapport R2, la concentration en H2 du gaz sortant du
réacteur est
calculée à partir d'un bilan atomique. La comparaison des résultats de
l'exemple
1 avec ceux de l'exemple 3 montre que la nature des matériaux du réacteur
(InconelTm versus quartz) n'a pas d'influence significative sur le taux de
conversion
du CO2.
Exemple 4
Cet exemple utilise le même équipement que l'exemple 3, i.e., basé sur
l'utilisation
d'un tube de quartz comme tube externe. Dans cet exemple, 02 est injecté dans
l'espace A, H2 est injecté dans l'espace B et CO2 dans l'espace C. La
température
ne pouvant être mesurée directement, la température utilisée est une valeur de
température d'équilibre thermodynamique calculée pour l'obtention d'un gaz
présentant le même rapport CO/CO2 que ce qui a été mesuré. Les débits des
intrants (litres standard (SL) à 25 C, 1 atm) par min) sont les suivants :
= CO2: 1,3 SL/min
= 02: 0,93 SL/min
= H2 :6,1 SL/min
Les résultats suivants ont été obtenus :
= Concentration en CO du gaz: 18.21 %
= Concentration de CO2 du gaz : 11,5%
= Concentration en hydrocarbure : trace
= Ratio CO/CO2 du gaz: 1,58
= Taux de conversion de CO2 en CO: 61,2 %
= Température d'équilibre T: 877 C
= Vitesse de 02 (à température T) : 8,20 m/s
= Vitesse de H2 (à température T, 1 atm) : 25,4 m/s
= Vitesse du CO2 (à température T, 1 atm) : 9,02 m/s
= Temps de séjour dans le réacteur : <0,05 s
= R2 = (H2-0O2) / (CO+CO2) : 2,26
39
CA 03166916 2022- 8- 3
Pour le calcul du rapport R2, la concentration en H2 du gaz sortant du
réacteur
est calculée à partir d'un bilan atomique.
L'applicabilité du procédé de production de gaz de synthèse a été démontrée
dans
les exemples ci-dessus, entre autres, sur la base de l'utilisation de CO2
comme
source de carbone. Le CO2 est une molécule très stable chimiquement, et
beaucoup plus stable qu'une molécule CaHpOy où a est compris entre 1 et 5.
Puisque les exemples ci-dessus ont démontré que le procédé est applicable pour
le CO2 qui s'avère plus difficile à transformer chimiquement qu'une molécule
de
type CaHp0y, il est raisonnable de conclure que le procédé est aussi
applicable
aux molécules de type CaHpOy comme source de carbone.
Bien que certaines réalisations de la présente méthode, et du réacteur qui
peut
être utilisé pour réaliser cette méthode, ont été décrites ci-dessus, la
méthode et
le réacteur ne sont pas limités à ces seules réalisations. Plusieurs
modifications
pourraient être effectuées à l'un ou l'autre des modes de réalisations décrits
ci-
dessus, et ce, sans sortir du cadre de la présente technologie telle
qu'envisagée.
***
Selon certains aspects, la présente demande concerne une ou plusieurs des
réalisations suivantes
Réalisation 1- Une méthode de production de gaz de synthèse comprenant
du monoxyde de carbone (CO) et de l'hydrogène (H2), dans laquelle le gaz de
synthèse est produit par une réaction de réduction d'un premier flux
comprenant
une source de carbone et un excès d'hydrogène au contact d'une Oxy-flamme, et
dans laquelle :
l'hydrogène provient d'un courant réducteur dont une première partie se
retrouve dans le premier flux et une seconde partie est utilisée pour générer
l'Oxy-
flamme par combustion de l'hydrogène en présence d'un second flux comprenant
de l'oxygène (02), le second flux provenant d'un courant oxydant,
Date Reçue/Date Received 2023-05-25
le premier flux et le second flux sont à une distance l'un de l'autre telle
que
l'Oxy-flamme soutient la réaction entre la source de carbone et l'hydrogène,
la distance entre le premier flux et le second flux est comprise entre 0,1 mm
et 100 mm,
la réaction de réduction est réalisée en l'absence de catalyseur solide, et
la source de carbone comprend du CO2 ou du CO2 et au moins un
hydrocarbure.
Réalisation 2- La méthode selon la réalisation 1, dans laquelle l'Oxy-
flamme
génère des espèces ioniques et des radicaux libres qui favorisent la
conversion
de la source de carbone en CO.
Réalisation 3- La méthode selon la réalisation 1 ou 2, dans laquelle la
source
de carbone comprend :
- du CO2; ou
- du CO2 et du méthane.
Réalisation 4- La méthode selon l'une quelconque des réalisations 1 à 3,
dans laquelle la réaction de réduction comprend une réaction inverse du gaz à
l'eau ou Reverse Water Gas Shift .
Réalisation 5- La méthode selon l'une quelconque des réalisations 1 à
4,
dans laquelle le courant réducteur est de l'hydrogène.
Réalisation 6- La méthode selon l'une quelconque des réalisations 1 à 4,
dans laquelle le courant réducteur comprend de l'hydrogène et la source de
carbone.
Réalisation 7- La méthode selon la réalisation 6, dans laquelle la
source de
carbone est du CO2.
Réalisation 8- La méthode selon l'une quelconque des réalisations 1 à 7,
dans laquelle le courant oxydant est de l'oxygène.
41
Date Reçue/Date Received 2023-05-25
Réalisation 9- La méthode selon l'une quelconque des réalisations 1 à
7,
dans laquelle le courant oxydant comprend de l'oxygène et la source de carbone
qui est du CO2.
Réalisation 10- La méthode selon l'une quelconque des réalisations 1 à
5,
dans laquelle le courant réducteur comprend uniquement de l'hydrogène, le
courant oxydant comprend uniquement de l'oxygène et la source de carbone est
alimentée par un courant indépendant.
Réalisation 11- La méthode selon la réalisation 10, dans laquelle la
source
carbone comprend du CO2.
Réalisation 12- La méthode selon la réalisation 10, dans laquelle la source
de
carbone comprend du CO2 et du méthane.
Réalisation 13- La méthode selon l'une quelconque des réalisations 1 à
12,
dans laquelle l'oxygène provient d'une réaction d'électrolyse de l'eau.
Réalisation 14- La méthode selon l'une quelconque des réalisations 1 à
13,
dans laquelle l'hydrogène provient d'une réaction d'électrolyse de l'eau.
Réalisation 15- La méthode selon l'une quelconque des réalisations 1 à
14,
dans laquelle la source de carbone provient d'un mélange gazeux issu d'un
procédé de gazéification ou de pyrolyse de biomasse.
Réalisation 16- La méthode selon l'une quelconque des réalisations 1 à
15,
dans laquelle la réaction de réduction est réalisée à une température moyenne
d'au moins 600 C.
Réalisation 17- La méthode selon l'une quelconque des réalisations 1 à
16,
dans laquelle la réaction de réduction est réalisée à une température moyenne
d'au moins 1200 C.
42
Date Reçue/Date Received 2023-05-25
Réalisation 18- La méthode selon l'une quelconque des réalisations 1 à
17,
dans laquelle la réaction de réduction est réalisée à une température moyenne
d'au plus 2200 C.
Réalisation 19- La méthode selon l'une quelconque des réalisations 1 à
18,
dans laquelle la distance entre le premier flux et le second flux est comprise
entre
0,3 mm et 50 mm.
Réalisation 20- La méthode selon l'une quelconque des réalisations 1 à
19,
dans laquelle la distance entre le premier flux et le second flux est comprise
entre
0,6 mm et 30 mm.
Réalisation 21- La méthode selon l'une quelconque des réalisations 1 à 20,
dans laquelle la réaction de réduction est réalisée en utilisant un ratio
molaire
H2/CO2 compris entre 2 et 7.
Réalisation 22- La méthode selon l'une quelconque des réalisations 1 à
21,
dans laquelle la réaction de réduction est réalisée en utilisant un ratio
molaire
02/CO2 compris entre 0,35 et 0,9.
Réalisation 23- La méthode selon l'une quelconque des réalisations 1 à
22,
dans laquelle la réaction de réduction est réalisée en utilisant un ratio
molaire
02/H2 compris entre 0,1 et 0,3.
Réalisation 24- La méthode selon l'une quelconque des réalisations 1 à
23,
dans laquelle le gaz de synthèse produit a un rapport molaire 1-12/C0 d'au
moins
1,8.
Réalisation 25- La méthode selon l'une quelconque des réalisations 1 à
24,
dans laquelle le gaz de synthèse produit a un rapport molaire H2/C0 d'au moins
2.
43
Date Reçue/Date Received 2023-05-25
Réalisation 26- La méthode selon l'une quelconque des réalisations 1 à
24,
dans laquelle le gaz de synthèse produit a un rapport molaire H2/C0 compris
entre
1,8 et 5,0.
Réalisation 27- La méthode selon l'une quelconque des réalisations 1 à
26,
dans laquelle le gaz de synthèse produit comprend en outre du CO2.
Réalisation 28- La méthode selon la réalisation 27, dans laquelle le gaz
de
synthèse produit a un ratio molaire en H2, CO et CO2 tel que (H2 - CO2) / (CO
+
CO2) k 2.
Réalisation 29- La méthode selon l'une quelconque des réalisations 1 à
28,
comprenant en outre un refroidissement du gaz de synthèse pour former un gaz
de synthèse refroidi.
Réalisation 30- La méthode selon la réalisation 29, comprenant en outre
une
condensation d'eau contenue dans le gaz de synthèse refroidi et récupération
de
l'eau.
Réalisation 31- La méthode selon la réalisation 30, dans laquelle au moins
une partie de l'eau récupérée est recyclée à l'étape de refroidissement.
Réalisation 32- Utilisation d'un gaz de synthèse produit par la méthode
telle
que définie selon l'une quelconque des réalisations 1 à 31, pour la
fabrication de
produits chimiques ou carburants.
Réalisation 33- Utilisation d'un gaz de synthèse produit par la méthode
telle
que définie selon l'une quelconque des réalisations 1 à 31, pour la
fabrication de
méthanol ou d'hydrocarbures synthétiques
Réalisation 34- Un réacteur pour produire un gaz de synthèse comprenant
du
monoxyde de carbone (CO) et de l'hydrogène (H2), ledit réacteur comprenant :
44
Date Reçue/Date Received 2023-05-25
une chambre de réaction dans laquelle le gaz de synthèse est produit par
une réaction de réduction d'un premier flux comprenant une source de carbone
et
un excès d'hydrogène au contact d'une Oxy-flamme,
au moins un premier moyen pour alimenter la chambre de réaction avec un
courant réducteur comprenant l'hydrogène, une première partie du courant
réducteur se retrouvant dans le premier flux et une seconde partie étant
utilisée
pour générer l'Oxy-flamme dans la chambre de réaction, par combustion de
l'hydrogène en présence d'un second flux comprenant de l'oxygène (02),
au moins un second moyen pour alimenter la chambre de réaction avec un
courant oxydant formant le second flux,
le premier flux et le second flux étant à une distance l'un de l'autre telle
que
l'Oxy-flamme soutient la réaction entre la source de carbone et l'hydrogène,
la distance entre le premier flux et le second flux est comprise entre 0,1 mm
et 100 mm,
la réaction de réduction est réalisée en l'absence de catalyseur solide, et
la source de carbone comprend du CO2 ou du CO2 et au moins un
hydrocarbure.
Réalisation 35- Le réacteur selon la réalisation 34 dans lequel l'Oxy-
flamme
génère des espèces ioniques et des radicaux libres qui favorisent la
conversion
de la source de carbone en CO.
Réalisation 36- Le réacteur selon la réalisation 34 ou 35, dans lequel
la source
de carbone comprend :
- du CO2; ou
- du CO2 et du méthane.
Réalisation 37- Le réacteur selon l'une quelconque des réalisations 34 à
36,
dans lequel la réaction de réduction est la réaction inverse du gaz à l'eau ou
Reverse Water Gas Shift .
Date Reçue/Date Received 2023-05-25
Réalisation 38- Le réacteur selon l'une quelconque des réalisations 34 à
37,
dans lequel le courant réducteur est de l'hydrogène.
Réalisation 39- Le réacteur selon l'une quelconque des réalisations 34 à
37,
dans lequel le courant réducteur comprend de l'hydrogène et la source de
carbone_
Réalisation 40- Le réacteur selon la réalisation 39, dans lequel la source
de
carbone est du CO2.
Réalisation 41- Le réacteur selon l'une quelconque des réalisations 34 à
40,
dans lequel le courant oxydant est de l'oxygène.
Réalisation 42- Le réacteur selon l'une quelconque des réalisations 34 à
40,
dans lequel le courant oxydant comprend de l'oxygène et la source de carbone
qui
est du CO2.
Réalisation 43- Le réacteur selon l'une quelconque des réalisations 34 à
42,
dans lequel le premier moyen pour alimenter le courant réducteur et le second
moyen pour alimenter le courant oxydant sont des tubes.
Réalisation 44- Le réacteur selon l'une quelconque des réalisations 34 à
42,
comprenant une pluralité de seconds moyens consistant en une pluralité de
tubes
permettant l'injection du courant oxydant dans la chambre de réaction, et une
pluralité de premiers moyens consistant en une pluralité d'ouvertures
permettant
l'injection du courant réducteur dans la chambre de réaction.
Réalisation 45- Le réacteur selon la réalisation 44, dans lequel chaque
ouverture est définie par un espace annulaire délimité par le diamètre externe
d'un
tube de la pluralité de tubes et s'étendant perpendiculairement à partir de la
paroi
externe du tube.
Réalisation 46- Le réacteur selon la réalisation 45, comprenant en outre
une
chambre de distribution du courant réducteur séparée de la chambre de réaction
par une paroi de séparation, ladite chambre de distribution et ladite paroi de
46
Date Reçue/Date Received 2023-05-25
séparation étant traversées par la pluralité de tubes, l'espace annulaire
s'étendant
perpendiculairement à partir de la paroi externe de chaque tube traversant
également la paroi de séparation
Réalisation 47- Le réacteur selon l'une quelconque des réalisations 34 à
38,
dans lequel le courant réducteur est de l'hydrogène qui est alimenté dans la
chambre réaction par le premier moyen consistant en un premier tube, le
courant
oxydant est de l'oxygène qui est alimenté dans la chambre réaction par le
second
moyen consistant en un second tube, et la source de carbone est alimentée par
un courant indépendant qui est injecté dans la chambre de réaction par au
moins
une ouverture située dans une paroi de la chambre de réaction.
Réalisation 48- Le réacteur selon la réalisation 47, dans lequel
l'ouverture est
formée par un troisième tube concentrique avec le premier tube et le second
tube,
le second tube formant le tube intérieur, le premier tube formant un tube
intermédiaire et le troisième tube formant un tube extérieur.
Réalisation 49- Le réacteur selon la réalisation 48, dans lequel
l'ouverture est
formée par un espace annulaire délimité par un diamètre interne du troisième
tube
et un diamètre externe du premier tube.
Réalisation 50- Le réacteur selon l'une quelconque des réalisation 47 à
49,
comprenant en outre une chambre de distribution séparée de la chambre de
réaction par une paroi de séparation, ladite chambre de distribution servant
pour
alimenter le courant indépendant comprenant la source de carbone et étant
traversée par le premier tube et le second tube.
Réalisation 51- Le réacteur selon l'une quelconque des réalisations 47 à
50,
dans lequel la source de carbone comprend du CO2.
Réalisation 52- Le réacteur selon l'une quelconque des réalisations 47 à
50,
dans lequel la source de carbone comprend du CO2 et du méthane.
47
Date Reçue/Date Received 2023-05-25
Réalisation 53- Le réacteur selon l'une quelconque des réalisations 34 à
52,
dans lequel l'oxygène provient d'une réaction d'électrolyse de l'eau.
Réalisation 54- Le réacteur selon l'une quelconque des réalisations 34 à
53,
dans lequel l'hydrogène provient d'une réaction d'électrolyse de l'eau.
Réalisation 55- Le réacteur selon l'une quelconque des réalisations 34 à
54,
dans lequel la source de carbone provient d'un mélange gazeux issu d'un
procédé
de gazéification ou de pyrolyse de biomasse.
Réalisation 56- Le réacteur selon l'une quelconque des réalisations 34 à
55,
dans lequel la chambre de réaction atteint une température moyenne d'au moins
.. 600 C pendant la réaction de réduction.
Réalisation 57- Le réacteur selon l'une quelconque des réalisations 34 à
56,
dans lequel la chambre de réaction atteint une température moyenne d'au moins
1200 C pendant la réaction de réduction.
Réalisation 58- Le réacteur selon l'une quelconque des réalisations 34 à
57,
dans lequel la chambre de réaction atteint une température moyenne d'au plus
2200 C pendant la réaction de réduction.
Réalisation 59- Le réacteur selon l'une quelconque des réalisations 34 à
58,
dans lequel la distance entre le premier flux et le second flux est comprise
entre
0,3 mm et 50 mm.
Réalisation 60- Le réacteur selon l'une quelconque des réalisations 34 à
59,
dans lequel la distance entre le premier flux et le second flux est comprise
entre
0,6 mm et 30 mm.
Réalisation 61- Le réacteur selon l'une quelconque des réalisations 34 à
60,
dans lequel la réaction de réduction est réalisée en utilisant un ratio
molaire
H2/CO2 compris entre 2 et 7.
48
Date Reçue/Date Received 2023-05-25
Réalisation 62- Le réacteur selon l'une quelconque des réalisations 34 à
61,
dans lequel la réaction de réduction est réalisée en utilisant un ratio
molaire
02/CO2 compris entre 0,35 et 0,9.
Réalisation 63- Le réacteur selon l'une quelconque des réalisations 34 à
62,
dans lequel la réaction de réduction est réalisée en utilisant un ratio
molaire 02/H2
compris entre 0,1 et 0,3.
Réalisation 64- Le réacteur selon l'une quelconque des réalisations 34 à
63,
dans lequel le gaz de synthèse produit a un rapport molaire Hz/CO d'au moins
1,8.
Réalisation 65- Le réacteur selon l'une quelconque des réalisations 34 à
64,
dans lequel le gaz de synthèse produit a un rapport molaire Hz/CO d'au moins
2.
Réalisation 66- Le réacteur selon l'une quelconque des réalisations 34 à
63,
dans lequel le gaz de synthèse produit a un rapport molaire H2/C0 compris
entre
1,8 et 5,0.
Réalisation 67- Le réacteur selon l'une quelconque des réalisations 34 à
66,
dans lequel le gaz de synthèse produit comprend en outre du CO2.
Réalisation 68- Le réacteur selon la réalisation 67, dans lequel le gaz
de
synthèse produit a un ratio molaire en H2, CO et CO2 tel que (H2 - CO2) / (CO
+
CO2) k 2.
Réalisation 69- Un système comprenant le réacteur tel que défini selon
l'une
quelconque des réalisations 34 à 68, couplé à un dispositif de refroidissement
du
gaz de synthèse pour former un gaz de synthèse refroidi.
Réalisation 70- Le système selon la réalisation 69, dans lequel le
dispositif de
refroidissement est un refroidisseur à contact direct.
Réalisation 71- Le système selon la réalisation 69 ou 70, comprenant en
outre
un appareil de condensation d'eau pour récupérer l'eau du gaz de synthèse
refroidi.
49
Date Reçue/Date Received 2023-05-25
Réalisation 72- Le système selon la réalisation 71, dans lequel
l'appareil de
condensation est un refroidisseur-condenseur.
Réalisation 73- Le système selon la réalisation 71 ou 72, comprenant en
outre
un équipement pour recycler au moins une partie de l'eau récupérée vers le
dispositif de refroidissement.
Date Reçue/Date Reeeived 2023-05-25